ENFERMEDAD DE CHAGAS
viernes, 12 de junio de 2015
martes, 9 de junio de 2015
EPIDEMIOLOGIA
COMPORTAMIENTO EN AMÉRICA
La enfermedad de Chagas, también llamada tripanosomiasis americana, es una enfermedad potencialmente mortal causada por el parásito protozoo Trypanosoma cruzi. Se encuentra sobre todo en zonas endémicas de 21 países de América Latina, donde se transmite a los seres humanos principalmente por las heces de insectos triatomíneos conocidos como vinchucas, chinches o con otros nombres, según la zona geográfica.
La Organización Panamericana de la Salud estimó para el año 2005, que el agente causal de la enfermedad había causado en los países endémicos de las Américas, pertenecientes a las iniciativas subregionales para la prevención y control de la enfermedad, entre 6 y 8 millones de personas infectadas, que se producen unos 40 a 45.000 casos nuevos anuales por transmisión vectorial, y que existen 108.595.000 de personas en riesgo de infectarse en zonas endémicas.
Además, se estima también que en las Américas, existirían cerca de 2 millones de mujeres en edad reproductiva infectadas por T. cruzi, de las cuales entre 4 a 8% transmitirían la infección al feto por vía transplacentaria, y consecuentemente nacerían anualmente unos 15.000 niños con Chagas congénito. La mayoría de ellos asintomáticos o paucisintomáticos, lo que plantea un desafío de eficacia, eficiencia y oportunidad a los servicios de salud.
COMPORTAMIENTO EN COLOMBIA
La prevalencia de tripanosomiasis en Colombia se ha estimado entre 700.000 y 1.200.000 habitantes infectados y 8.000.000 individuos en riesgo de adquirir la infección, de acuerdo con la distribución geográfica y las especies rectoras descritas en la fase exploratoria del “Programa Nacional de Prevención y Control de la Enfermedad de Chagas”, que comenzó oficialmente desde el año 1.996, por iniciativa del Ministerio de Salud y la participación de Centros de Investigación Nacionales con experiencia en la problemática de la enfermedad.
El objetivo del programa fue establecer la situación epidemiológica de la enfermedad en el país, y con base en la información sobre distribución de los vectores, índices de infestación domiciliaria, índices de prevalencia de infección en escolares y condiciones de vivienda, realizar la estratificación de municipios y la priorización de acciones de control. En total se estratificaron 539 municipios de 15 departamentos del país en áreas de alto, medio y bajo riesgo de infección.
En Colombia, el T. cruzi se detecta frecuentemente a todo lo largo del Valle del Río Magdalena, en la región del Catatumbo, la Sierra Nevada de Santa Marta, el piedemonte de los Llanos Orientales y la Serranía de la Macarena. Los departamentos que presentan una mayor endemia son: Santander, Norte de Santander, Cundina-marca, Boyacá, Meta, Casanare, Arauca, Tolima, Huila, y Bolívar.
Se estima que alrededor del 5% de la población colombiana esta infectada y cerca del 20% se encuentra bajo riesgo de adquirir la infección, dependiendo de la distribución geográfica de los vectores.
Durante los últimos 60 años numerosos autores han estudiado la distribución de los insectos triatomineos y sus tasas de infección con flagelados en Colombia.
lunes, 8 de junio de 2015
TAXONOMIA
Reino: Protista
AGENTE CAUSAL
Trypanosoma cruzi es el agente causante de la tripanosomiasis americana, es transmitido por varias especies de insectos hematófagos triatominos. Estos vectores se encuentran en grandes cantidades en la naturaleza, donde transmiten el parásito a otras muchas especies de mamíferos a partir del reservorio natural. Estos insectos viven en zonas endémicas, en rincones y grietas de viviendas precarias, y se infectan al succionar la sangre de los seres humanos u otros mamíferos que portan tripomastigotes circulantes.
Subreino: Protozoa
Phylum: Sarcomastigophora
Subphylum: Mastigophora
Clase: Zoomastigophorea
Orden: Kinetoplastida
Suborden: Trypanosomatina
Familia: Trypanosomatidae
Genero: Trypanosoma
Especie: T. cruzi
AGENTE CAUSAL
Trypanosoma cruzi es el agente causante de la tripanosomiasis americana, es transmitido por varias especies de insectos hematófagos triatominos. Estos vectores se encuentran en grandes cantidades en la naturaleza, donde transmiten el parásito a otras muchas especies de mamíferos a partir del reservorio natural. Estos insectos viven en zonas endémicas, en rincones y grietas de viviendas precarias, y se infectan al succionar la sangre de los seres humanos u otros mamíferos que portan tripomastigotes circulantes.
Los reservorios naturales de este parásito lo constituyen los armadillos, marsupiales (Didelphis o zarigüeyas), roedores, murciélagos y primates silvestres, además de ciertos animales domésticos como perros, gatos, incluso ratas (Rattus rattus). Es transmitida al hombre comúnmente por grandes hematófagos redúvidos de la subfamilia Triatominae (triatominos) como el Triatoma infestans
 |
| Triatoma infestans |
sábado, 6 de junio de 2015
ENFERMEDAD DE CHAGAS UNA ENFERMEDAD DESATENDIDA
La enfermedad de Chagas es una enfermedad tropical considerada como desatendida, se estima que 10 millones de personas sufren esta olvidada enfermedad, a pesar de su antigüedad
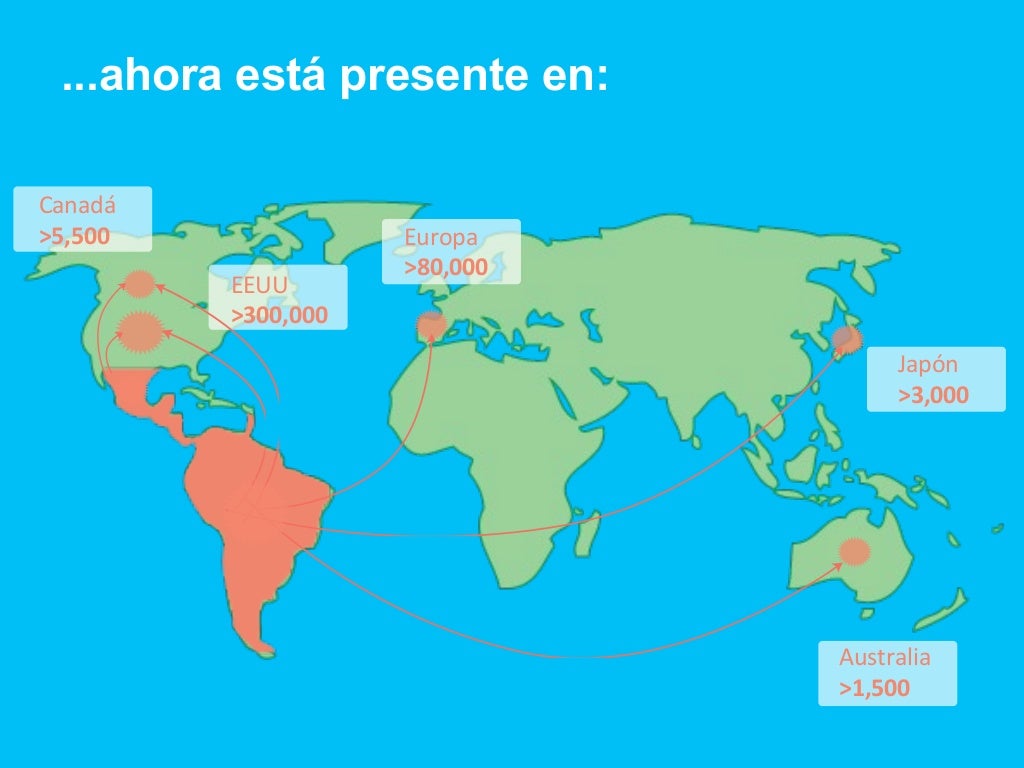
La enfermedad de chagas es endémica en América latina, pero en las ultimas décadas se ha observado con frecuencia en los Estados Unidos de América, Canadá y muchos países Europeos y algunos del Pacifico Occidental, esto debido a la permanente movilidad de la población entre América Latina y el resto del mundo.
La enfermedad de Chagas es un problema de salud pública global
¿QUE ES LA ENFERMEDAD DE CHAGAS?
La enfermedad de chagas, también conocida como Tripanosomiasis americana, es una enfermedad parasitaria tropical, causada por un protozoo flagelado Trypanosoma cruzi. Es diseminada por insectos hematófagos (que se alimentan de sangre) infectados, conocidos como vinchucas (o "chinche gaucha" o "chinche besucona" o "chupadora" o "voladora" o "barbeiros" o "chipos")
VÍAS DE TRANSMISIÓN
- VECTORIAL:
Cuando el parásito pica a una persona para alimentarse de su sangre, defeca y deposita los parásitos en la piel, al rascarse la picadura, la persona introduce los parásitos en su cuerpo.
- TRANSFUSIONAL:
con chagas; o a través de un transplante de órganos

- CONGÉNITA:
- ORAL:
- ACCIDENTAL:
PERIODOS DE INCUBACIÓN
Los periodos de incubación son variables dependiendo de la vía de transmisión, de las formas infectantes del parásito, de la cepa, de la condición inmune del paciente
- Vectorial: 4 – 15 días
- Transfusional: 30 – 40 días
- Oral: 3 – 22 días
- Accidental: Aproximadamente 20 días
- Congénita: 4 a 9 meses. Durante el parto
FASES CLINICAS
- AGUDA
Asintomática en aproximadamente el 70% de los infectados
La incubación es de unos 14 días
El cuadro clínico puede durar de 6 a 8 semanas
El cuadro clínico puede durar de 6 a 8 semanas
CUADRO CLÍNICO
- Fiebre mayor de 7 días
- Mialgias
- Cefalea
- Linfadenopatias
- Mal estado general
Se pueden presentar signos de puerta de entrada:
Signo de Romaña
- Edema bipalpebral
- Conjuntivas Hiperemicas
- Inflamación de las glándulas lacrimales
Chagoma de inoculación
- Lesión cutanea, forunculoide con adenopatia regional
2. CRÓNICA
El periodo de incubación va de 10 a 20 años
Forma Indeterminada:
Es la forma de la fase crónica de la enfermedad de Chagas sin manifestaciones clínicas, que puede iniciarse luego de finaliza la fase aguda. En este período no se expresa ninguna sintomatología o molestia. Esta forma puede durar de 10 a 20 años o prolongarse incluso por el resto de la vida, lo cual ocurre en el 70% de los pacientes.
El diagnóstico en esta fase se confirma mediante serología positiva (anticuerpos IgG) en dos pruebas serológicas de principio diferente, en ausencia de manifestaciones clínicas, de hallazgos electrocardiográficas compatibles con cardiopatía chagásica crónica y con estudios radiográficos de tórax y digestivos normales.
En zonas endémicas en las que persiste la transmisión vectorial, esas personas sirven de reservorio natural de la infección por T. cruzi y contribuyen al mantenimiento del ciclo vital del parásito. Estos pacientes pueden ser identificados mediante encuestas epidemiológicas y tamizajes serológicos como los que se realizan en banco de sangre
Forma Cardíaca:
La cardiomiopatía chagasica es la consecuencia clínica más importante de la infección por T. cruzi en Colombia y se detecta clínicamente porque las personas presentan manifestaciones de disnea, sensación de palpitaciones, edemas, síncopes, eventos cerebro-vasculares y paro cardiaco.
 Entre los signos más tempranos de afectación cardiaca
está la aparición de alteraciones en el electrocardiograma (ECG),
principalmente bloqueo de rama derecha del haz de Hiss, y otras
bradiarritmias, las cuales pueden aparecer años antes que los síntomas. La
baja prevalencia del bloqueo de rama izquierda es un rasgo distintivo del
cuadro electrocardiográfico de la miocardiopatía chagasica. Las
consecuencias clínicas más importantes de la cardiomiopatía chagasica
son: la insuficiencia cardiaca, arritmias cardíacas y la tromboembolia.
Entre los signos más tempranos de afectación cardiaca
está la aparición de alteraciones en el electrocardiograma (ECG),
principalmente bloqueo de rama derecha del haz de Hiss, y otras
bradiarritmias, las cuales pueden aparecer años antes que los síntomas. La
baja prevalencia del bloqueo de rama izquierda es un rasgo distintivo del
cuadro electrocardiográfico de la miocardiopatía chagasica. Las
consecuencias clínicas más importantes de la cardiomiopatía chagasica
son: la insuficiencia cardiaca, arritmias cardíacas y la tromboembolia.
Las arritmias son probablemente la complicación más frecuente, que lleva a la utilización de fármacos antiarrítmicos e incluso en muchas ocasiones de implantación permanente de marcapasos. En otros casos, aún más graves, la afectación de la función cardíaca progresa a una falla cardíaca, que incluso puede llevar al requerimiento de un trasplante cardíaco.
La cardiomiopatía chagasica es la consecuencia clínica más importante de la infección por T. cruzi en Colombia y se detecta clínicamente porque las personas presentan manifestaciones de disnea, sensación de palpitaciones, edemas, síncopes, eventos cerebro-vasculares y paro cardiaco.
 Entre los signos más tempranos de afectación cardiaca
está la aparición de alteraciones en el electrocardiograma (ECG),
principalmente bloqueo de rama derecha del haz de Hiss, y otras
bradiarritmias, las cuales pueden aparecer años antes que los síntomas. La
baja prevalencia del bloqueo de rama izquierda es un rasgo distintivo del
cuadro electrocardiográfico de la miocardiopatía chagasica. Las
consecuencias clínicas más importantes de la cardiomiopatía chagasica
son: la insuficiencia cardiaca, arritmias cardíacas y la tromboembolia.
Entre los signos más tempranos de afectación cardiaca
está la aparición de alteraciones en el electrocardiograma (ECG),
principalmente bloqueo de rama derecha del haz de Hiss, y otras
bradiarritmias, las cuales pueden aparecer años antes que los síntomas. La
baja prevalencia del bloqueo de rama izquierda es un rasgo distintivo del
cuadro electrocardiográfico de la miocardiopatía chagasica. Las
consecuencias clínicas más importantes de la cardiomiopatía chagasica
son: la insuficiencia cardiaca, arritmias cardíacas y la tromboembolia. Las arritmias son probablemente la complicación más frecuente, que lleva a la utilización de fármacos antiarrítmicos e incluso en muchas ocasiones de implantación permanente de marcapasos. En otros casos, aún más graves, la afectación de la función cardíaca progresa a una falla cardíaca, que incluso puede llevar al requerimiento de un trasplante cardíaco.
Forma Digestiva:
La destrucción de la inervación neurovegetativa entérica causada por la infección por T. cruzi provoca disfunción del sistema digestivo. Las alteraciones son más frecuentes en el esófago y colon cursando con megaesófago y megacolon respectivamente.
Esta forma de la enfermedad ha sido descrita en las poblaciones al sur del ecuador, en Colombia no es frecuente
MORFOLOGIA
AMASTIGOTE:
Forma de multiplicación del parásito al interior de las células del reservorio.
Redondo u ovoide son flagelo, mide 1.5 a 4.0 μm, en el se pueden apreciar el núcleo y el cinetoplasto, que forman nidos tisulares o seudoquistes intracelulares.
Forma de multiplicación del parásito al interior de las células del reservorio.
Redondo u ovoide son flagelo, mide 1.5 a 4.0 μm, en el se pueden apreciar el núcleo y el cinetoplasto, que forman nidos tisulares o seudoquistes intracelulares.
TRIPOMASTIGOTE SANGUINEO:
Se encuentra circulante en la sangre del hospedero. Es la forma que infecta al vector a partir del reservorio, tiene forma fusiforme y mide 12 a 30 μm, incluyendo el flagelo, presenta un gran núcleo central, con un cinetoplastogrande y de ubicación subterminal en el extremo posterior

EPIMASTIGOTE:
Forma que se multiplica en el tracto digestivo del vector.
De aspecto fusiforme, cinetoplasto en posición anterior y cerca del núcleo, la membrana ondulante es pequeña y posee flagelo.
TRIPOMASTIGOTE METACICLICO:
Forma infectante que eyecta el vector en sus heces y por tanto la forma infectante para el humano.
Formas muy similares a los tripomastigotes sanguineos, pero mas cortos, finos y activos, forma no replicativa.
Se encuentra circulante en la sangre del hospedero. Es la forma que infecta al vector a partir del reservorio, tiene forma fusiforme y mide 12 a 30 μm, incluyendo el flagelo, presenta un gran núcleo central, con un cinetoplastogrande y de ubicación subterminal en el extremo posterior

EPIMASTIGOTE:
Forma que se multiplica en el tracto digestivo del vector.
De aspecto fusiforme, cinetoplasto en posición anterior y cerca del núcleo, la membrana ondulante es pequeña y posee flagelo.
TRIPOMASTIGOTE METACICLICO:
Forma infectante que eyecta el vector en sus heces y por tanto la forma infectante para el humano.
Formas muy similares a los tripomastigotes sanguineos, pero mas cortos, finos y activos, forma no replicativa.
CICLO DE VIDA

El hospedero vertebrado infectado por T. cruzi presenta el parásito circulante en sangre en forma de tripomastigote. Cuando el vector pica al hospedero vertebrado y se alimenta de su sangre infectada, los parásitos que ingiere sufren un transformación madurativa en el intestino medio como epimastigotes, y luego en el intestino grueso se transforman en tripomastigotes metacíclicos infecciosos, que se descargan en las heces al picar a un nuevo vertebrado. El vector defeca cerca de la picadura y los tripomastigotes presentes pueden penetran en el nuevo huésped a través de la picadura, piel intacta o de la conjuntiva ocular. Una vez en el organismo del vertebrado, el parásito invade les células cercanas al sitio de inoculación adquiriendo la forma intracelular (amastigote) que provoca daño directo e indirecto a los tejidos. Al multiplicarse el amastigote, genera tripomastigotes que se liberan a la circulación sanguínea, para continuar infectando células de diferentes tejidos.
DIAGNOSTICO
Para el diagnóstico de la enfermedad de Chagas se utilizan métodos de acuerdo a la fase clínica en que se encuentre la enfermedad
Diagnóstico parasitologico:
Los métodos parasitologicos son los que permiten detectar la presencia de parásito y son usados en la fase aguda de la enfermedad
Métodos directos:
1. EXAMEN EN FRESCO PARA LA DETECCIÓN DE TRIPOMASTIGOTES:
Se toma una gota de sangre por punción digital, se coloca entre lámina y laminilla y se observa al microscopio de luz con objetivo de10X y 40X. Se buscan tripanosomas moviéndose vigorosamente. Es un método muy sencillo que puede realizarse en cualquier laboratorio
https://www.youtube.com/watch?v=n7aYVlsxoWE
2. GOTA GRUESA:
Es una técnica que utiliza métodos de coloración para visualizar el parasito pero con la ventaja que permite concentrar varias capas de sangre, 20 a 30 en relación con el extendido de sangre. Por el proceso al que es sometida la sangre, la morfología del parasito puede verse un poco modificada. La sensibilidad de esta prueba es intermedia entre los anteriores métodos y los de concentración como el microhematocrito y el Strout. Esta prueba presenta ventajas si se utiliza en zonas donde coexiste transmisión de malaria y de Chagas por la experiencia en su uso. La realización de la gota gruesa como rutina en estas regiones para el diagnóstico de malaria en febriles puede detectar casos agudos de enfermedad de Chagas
3. EXTENDIDO DE SANGRE PERIFÉRICA:
Después de obtener una muestra de sangre por punción capilar, se extiende una gota sobre una lámina coloreada con Romanowski modificado, Giemsa o Wright. Se buscan los tripomastigotes metacíclicos fijados, con sus estructuras características: forma alargada en C o en S, con núcleo, cinetoplasto, flagelo y membrana ondulante. Es una prueba que permite identificar la morfología del parasito pero presenta baja sensibilidad.
3. MICROHEMATOCRITO:
Se obtiene una muestra de sangre en un tubo capilar o microhematocrito heparinizado, centrifugarlo a 8.000-12.000 rpm y observar al microscopio la interfase entre el plasma y los glóbulos rojos (la capa leucocitaria) o pegando el capilar con una cinta a una lamina y dándole giros para observarlo, en ambos casos con objetivo 40X buscando la presencia de tripomastigotes en movimiento. Otra alternativa cuando el anterior procedimiento da negativo es romperlo con mucha precaución al nivel de la interfase y observar entre lámina y laminilla o realizar un extendido para tinción con coloración con Romanosky. Este método también se puede desarrollar en un laboratorio de cualquier nivel. La técnica es una de las más sensibles, siendo ampliamente utilizada para diagnosticar casos de Chagas congénito
5. MÉTODO DE STROUT:
Se obtiene una muestra de sangre (5-10 ml) sin anticoagulante, se deja que se forme el coagulo y se retraiga. El suero obtenido se doble centrifuga, primero a baja velocidad (1.500 RPM) para eliminar los glóbulos rojos restantes y luego a mayor velocidad (3.500 a4000 RPM) para concentrar los parásitos en el sedimento. Finalmente se descarta el sobrenadante y a partir del sedimento se realiza un montaje directo en fresco entre lámina y laminilla para buscar el parásito o realizar un extendido para tinción con coloración. De igual forma este método también puede ser desarrollado en un laboratorio de cualquier nivel. Es una de las técnicas más sensibles porque utiliza el mayor volumen de sangre y permite concentrar los parásitos
Métodos indirectos:
1. XENODIAGNOSTICO:
Consiste en alimentar con sangre del paciente a vectores en estadio 3° o 5°, libres de infección y criadas en el laboratorio. El xenodiagnostico es natural cuando los triatomino se alimentan directamente del paciente dejándolos durante 30 minutos para que obtengan la sangre, utilizando 40 ninfas distribuyéndolas de 10 por cada recipiente de madera o de plástico, protegidos con tela de filtro y colocados sobre la piel del paciente durante 30 minutos, se recomienda repetir este procedimiento una o dos veces más, con intervalo de un mes.
El procedimiento es artificial cuando la sangre del paciente es extraída por venopunción, heparinizada y colocada en recipientes mantenidos a la temperatura corporal y con membranas finas de latex, a través de las cuales los insectos se alimentan. Por razones éticas el uso del método natural es restringido y se prefiere el artificial, necesitándose una infraestructura de laboratorio de referencia Este método no se recomienda para los servicios de salud y su realización es solo posible en algunos centros de investigación. A los 30 y 60 días después de ser alimentados los triatominos, se examinan sus heces e intestinos bajo el microscopio para detectar tripomastigotes o epimastigotes del T. cruzi.
2. HEMOCULIVO:
Para el hemocultivo se emplean medios líquidos tales como LIT (triptosa de infusión de hígado) o BHI (infusión cerebro-corazón). La realización de hemocultivos de forma seriada aumenta la positividad de la técnica. El tiempo en que normalmente el hemocultivo se positiviza es de 30 – 60 días.
3. REACCION EN CADENA DE LA POLIMERASA (PCR):
Esta técnica se basa en la amplificación de fragmentos de minicírculos de ADN del cinetoplasto, ó de otros ácidos nucleicos del parásito.
Diagnóstico serologico:
Permiten detectar la presencia de anticuerpos contra T. cruzi. Los métodos serológicos son usados para el diagnóstico en la fase crónica de la enfermedad
Detección de anticuerpos IgG: El diagnóstico de la Enfermedad de Chagas en fase crónica se hace a través de la presencia de anticuerpos IgG anti T. cruzi, detectados al menos por dos técnicas serológicas de principios diferentes de preferencia con titulación
Pueden ser empleadas dos de las siguientes tres técnicas:
1. ENSAYO INMUNOENZIMATICO (ELISA):
Permite observar la presencia de anticuerpos antiinmunoglobulinas ligados a una enzima que en presencia de su sustrato forma un producto colorido. Por ser una prueba colorimétrica el resultado es definido por la lectura de la absorbancia o densidad óptica y usualmente cada estuche comercial tiene su forma de calcular el punto de corte, por encima o por debajo del cual las muestras se consideran reactivas o no. Los resultados alrededor de los puntos de corte se clasifican como indeterminadas y en ese caso la muestra deben ser remitida a los laboratorios de referencia para ser procesadas por otras técnicas
2. INMUNOFLUORESCENCIA INDIRECTA (IFI):
Los anticuerpos presentes en el suero del paciente infectado con T. cruzi son colocados sobre una lamina que contiene el antígeno (formas epimastigotes de T. cruzi) y son revelados a través de anticuerpos anti-inmunoglobulina humana unidos a fluoresceína. El resultado se visualiza en microscopio de fluorescencia con luz ultravioleta y presentar falsos positivos al presentarse reactividad cruzada con otros parásitos como Leishmania spp o Trypanosoma rangeli.
Con títulos mayor o igual a 1:32 se considera que la prueba es reactiva.
3. HEMOAGLUTINACION INDIRECTA (HAI):
La superficie de los Hematíes son sensibilizados con antígenos de T. cruzi adsorbidos y en presencia de los anticuerpos contra el parásito presentes en el suero del paciente se produce una reacción antígeno –anticuerpo que genera aglutinación de los eritrocitos, la cual puede ser visualizada. El informe del resultado depende del punto de corte señalado por la información técnica del kit
TRATAMIENTO
La enfermedad de Chagas puede tratarse con benznidazol y nifurtimox. Ambos medicamentos son eficaces casi al 100% para curar la enfermedad si se administran al comienzo de la infección en la fase aguda. Sin embargo, su eficacia disminuye a medida que la enfermedad progresa a la fase cronica.
El tratamiento con estos medicamentos también está indicado:
- Infección congénita
- Pacientes menores de 18 años en fase crónica independiente de la forma clínica
- Paciente en fase crónica con reactivación de la infección debido a terapia inmunosupresora (pacientes sometidos a trasplantes) o por otras causas de inmunosupresión (VIH)
- Exposición accidental a material conteniendo formas vivas de T. cruzien caso de reactivación de la infección (por ejemplo, por inmunodepresión), en niños que padecen infección congénita y en los pacientes al principio de la fase crónica.
El seguimiento del tratamiento debe realizarse bajo supervisión médica con una
frecuencia de contacto con el paciente de al menos una vez por semana buscando
signos de intolerancia a la medicación. Además, se recomienda efectuar un
análisis de laboratorio previo al inicio del tratamiento, a los 20 días de iniciado el
tratamiento y una vez finalizado el mismo, que incluya: cuadro hemático con
recuento de plaquetas, TGO y TGP, Nitrógeno ureico y creatinina.
El benznidazol y el nifurtimox no deben administrarse a las embarazadas ni a las personas con insuficiencia renal o hepática. El nifurtimox también está contraindicado en personas con antecedentes de enfermedades del sistema nervioso neurológicas o trastornos psiquiátricos.
CONTROL Y PREVENCIÓN
No hay vacuna contra la enfermedad de Chagas.
El método más eficaz para prevenirla es el control vectorial.
La OMS recomienda los siguientes métodos de prevención y control:
- Rociamiento de las casas y sus alrededores con insecticidas.
- Mejorar las condiciones de las viviendas para prevenir la infestación por el vector. (techos de zinc, paredes pañetadas y pisos de cemento)
- Medidas de prevención personales, como el empleo de mosquiteros.
- Mejora hábitos de orden y aseo de las viviendas
- Ubicar camas de gallinas, perros, gatos etc, fuera de la casa
- Buenas prácticas higiénicas en la preparación, el transporte, el almacenamiento y el consumo de los alimentos;
- Realizar pruebas de tamizaje a las unidades de sangre donada
- Realizar pruebas de tamizaje en órganos, tejidos o células donados y en los receptores de éstos.
- Realizar pruebas a recién nacidos y otros niños de las madres infectadas, para diagnosticar y tratar tempranamente la enfermedad.
 |
| Realizar limpieza de la vivienda |
 |
| Realizar búsqueda de los vectores |
BIBLIOGRAFIA
- http://www.who.int/mediacentre/factsheets/fs340/es/
- Protocolo para la Vigilancia en salud pública para chagas INS Colombia
- Guía para la atención clínica integral del paciente con enfermedad de chagas
- Enfermedad de chagas en Colombia, problematica de la enfermedad de chagas. Simposio Internacional, Academia Nacional de Medicina, Buenos Aires, 1999
Suscribirse a:
Comentarios (Atom)
